美国食品药品监督管理局(FDA)化妆品注册系统于2023年12月16日正式开放!自2022年12月29日,美国颁发《2022年化妆品法规现代化法案》(MoCRA)以来,FDA一直在不断完善注册要求及新注册系统。新的注册系统Cosmetic Direct于2023年12月14日结束内测,于2023年12月16日正式开放。
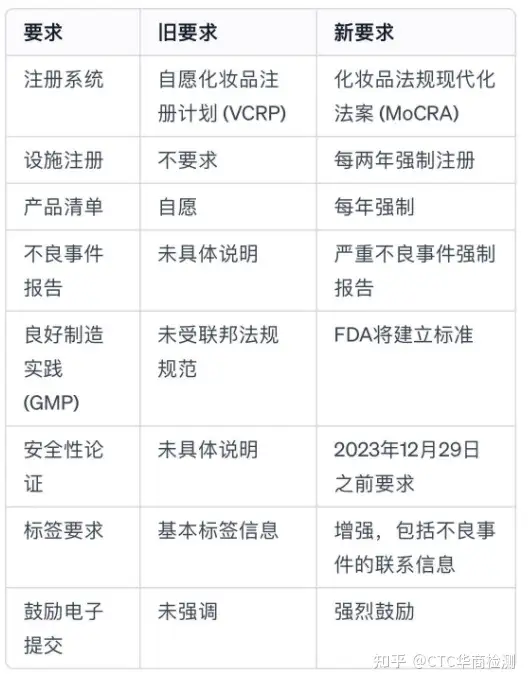
下是最新FDA化妆品注册要求与原先要求的差异直观矩阵展示:
合规的时间节点:
2023 年 11 月 8 日,FDA 发布指导意见,表示打算将MoCRA 规定的化妆品设施注册和化妆品列名要求的执行延迟六个月,以帮助确保行业有足够的时间提交此类设施注册和产品列名信息。
FDA 不打算在法定截止日期 2023 年 12 月 29 日后的六个月内或 2024 年 7 月 1 日之前额外执行与化妆品设施注册和化妆品上市相关的要求,以便为受监管行业提供额外的时间来遵守这些要求要求。
此外,FDA 不打算对 2022 年 12 月 29 日之后首次从事化妆品生产或加工的设施的所有者或经营者强制执行注册要求,也不打算对 2022 年 12 月 29 日之后首次上市的化妆品执行上市要求,直到2024 年 7 月 1 日。
建议化妆品出口企业尽快完成注册以尽早实现合规。
美国 FDA 扩大对化妆品的监管
在 MoCRA 通过之前,美国食品与药品管理局 (United States Food &药品管理局 (FDA) 在化妆品注册和 GMP 要求方面的权力有限。
在新的 FDA 化妆品法规(2023 年底生效)之前,FDA 已:
- 对化妆品注册、化妆品测试、上市前通知、许可或批准的权限有限。
- 对化妆品良好生产规范 (GMP) 的权力有限;强制性风险标签;不良事件报告;和化妆品召回。
美国 FDA 不能对化妆品制造商提出注册要求,但制造商可以自愿遵守美国 FDA 注册规定。
MoCRA(化妆品监管现代化法案)扩大了 FDA 对化妆品和个人护理产品的监管权限。这包括强制设施注册、强制报告不良事件以及授予 FDA 在必要时强制召回化妆品产品的权力。
注意:其他法规也适用于化妆品,例如《公平包装和标签法》(FPLA)、《1960 年颜色添加剂修正案法》和《1970 年毒物预防包装法》。
2022 年化妆品监管现代化法案 (MoCRA)
化妆品生产监管合规性
2022 年 12 月 29 日,随着 2022 年化妆品监管现代化法案 (MoCRA) 的通过,对 FD&C 法案进行了更新,详细说明了化妆品制造商的新监管合规要求。
除了满足ISO 22716 要求之外,在美国制造或分销的化妆品还必须符合联邦食品、药品和化妆品 (FD&C) 法。
FDA 将于 2023 年底发布有关 MoCRA(针对化妆品制造商)的进一步更新。
以下简要概述了 FDA 的化妆品新法规将如何影响制造商。
化妆品制造商:法规和政策注册要求
化妆品制造商何时必须向 FDA 注册?
现有设施
FDA对现有化妆品设施的注册要求(摘录):
- (A) 自 2022 年 12 月 29 日起,每个拥有或经营从事制造或加工在美国经销的化妆品的工厂的人均应向[卫生与公众服务部部长]注册每个工厂。晚于 2023 年 12 月 29 日。
新设施
FDA对新化妆品设施的注册要求(摘录):
- (B) 拥有或经营在 2022 年 12 月 29 日之后首次从事制造或加工用于在美国分销的化妆品的设施的每个人,均应在首次从事此类活动后 60 天或 (A) 项规定的注册截止日期后 60 天,以较晚者为准。
化妆品法规结构化产品标签 (SPL) 框架。
现在,化妆品工厂注册和产品清单必须遵循结构化产品标签 (SPL) 框架。 SPL 是 FDA 对美国所有药品和药品注册的标准要求,根据新的 MoCRA,化妆品现在也将属于这一框架。
“SPL”是什么意思?
SPL 是“结构化产品标签”的缩写。
它是由 Health Level Seven International (HL7) 开发的文档标记标准,并被 FDA 采用,用于电子交换药品和制造设施信息。在向 FDA 提交产品标签时,此格式强制执行一致的结构和标准术语。
SPL 文档包括标题和文本正文。
- 标头可以包含产品类型、作者和版本控制等信息。
- 文档正文可以包括结构化文本和数据元素格式的产品信息。
化妆品制造与销售验证协议
实施化妆品设施注册和产品清单的 SLP 和验证协议(SPL 编码/SPL 指南)
- 2023 年 10 月,FDA 发布了关于实施 SPL 的新指南,其中包括化妆品设施注册和产品清单的验证协议。
- 更新后的 SPL 指南不仅限于化妆品;还包括涵盖药物、生物制品和医疗器械的部分。
- 这是一份技术性很强的文档 审查了此 SPL 框架所需的逐行编码。 点击此处阅读有关 SPL 的新 FDA 媒体新闻稿。
联邦食品、药品和化妆品法案 GMP 更新
2022 年化妆品监管现代化法案 (MoCRA) 更新了 FD&C 法案,授予 FDA 对美国化妆品生产和销售的额外权力。
此前,FDA 没有针对化妆品良好生产规范 (GMP) 的官方规范,并鼓励采用国际公认的标准ISO 22716. MoCRA 现在允许 FDA 围绕化妆品生产 GMP 制定具体法规。
随着 MoCRA 的生效,FDA 权力扩大(以及新的化妆品 GMP 要求)将影响化妆品制造商的一些例子包括:
- 记录访问:在某些情况下,FDA 将能够访问与化妆品相关的记录,包括安全记录 (21 USC 364f)。
- 强制召回授权:FDA 可以下令强制召回化妆品(如果责任人自愿拒绝这样做)。当化妆品对健康造成严重不良影响或掺假时,这可能是必要的(21 USC 364g)。
- 不良事件报告:负责人必须在 15 个工作日内向 FDA 报告因美国化妆品引起的严重不良事件 (21 USC 364a)。
- 安全证实: 负责人必须“确保并保存支持此类化妆品安全性的记录”(21 USC 364d(a ))。换句话说,没有强制要求对化妆品进行具体测试,但必须有科学专家支持的证据或信息来证明化妆品可以安全使用。
- 良好生产规范:到 2026 年 1 月,FDA 将制定有关化妆品的 GMP 法规。到目前为止,FDA 还没有针对化妆品的具体规定,但强烈建议制造商遵守 GMP 原则。由于化妆品将出台新的 GMP 法规,以下 FDA GMP 化妆品指南已恢复为草案以供进一步审查 (21 USC 364b)。
化妆品不良事件报告:实际应用示例
“在 MoCRA 颁布之前,FDA 完全依赖化妆品公司和消费者自愿报告的不良事件。公众可以通过 FDA 的产品安全报告计划 MedWatch 向美国 FDA 报告不良事件
。根据 MoCRA 的规定,国内使用的特定化妆品的负责人必须报告相关的严重不良事件。”摘自 CRS 报告 R47826。

部分过审案例