2017年4月,欧盟医疗器械法规(MDR)和体外诊断医疗器械法规(IVDR)发布,法规中定义了欧盟UDI系统的相关要求此外,可通过该标识对欧盟医疗器械数据库(EUDAMED)中的医疗器械进行分组,为了能提高医疗器械不良时间报告的效率,欧盟法规中还引入了新概念“Basic UDI-DI”。Basic UDI是企业基于一定的编码规则(比如基于GS1),自己规定的一类产品的代码。这个代码不会出现在产品上,但会出现在其他文件中,比如:1.CE证;2.CE符合性声明;3.CE技术文件;4.SSCP;5.自由贸易证书等。该法规将要求制造商,在欧盟境内分销的医疗器械标识名为唯一器械标识(UDI)特定代码。
什么是UDI编码?
UDI全称Unique Device Identification 是医疗器械唯一标识:指呈现在医疗器械产品或者包装上的由数字、字母或者符号组成的代码,用于对医疗器械进行唯一性识别。
医疗器械唯一标识包括什么?
UDI(唯一器械标识)由固定器械标识 (DI) 和可变生产标识 (PI) 组成。UDI 必须提供人工可读(纯文本)和机器可读两种格式,后者使用自动识别与数据采集 (AIDC) 技术。
目前UDI 编码只影响医疗器械类进出口行业,未来在中国是否会影响所有医疗器械行业,还不确定,但我国也在制作医疗器械唯一标识系统规则(征求意见稿 )也许在不远的未来,也会在医疗器械中进行UID打码。
UDI代码应在哪些领域应用?
一级或更高层次的医疗器械包装上通常必须贴有 UDI 代码。集装箱不属于更高层次的医疗器械包装。由于 GTIN(全球贸易项目代码,由 GS1 发布的标识码)对于每个层次的医疗器械包装具有唯一性,因此 UDI 代码对于每一层次的包装也具有唯一性。
执行时间要求
欧盟医疗器械新规要求,在欧洲境内上市销售的医疗器械及体外诊断设备,在如下日期前应载有UDI:
2021年5月26日,植入及Class-Ⅲ类器械产品(暂不强制数据库申报)
2023年5月26日,ClassⅡ-A&B类器械产品,Class D类体外诊断设备
2025年5月26日,ClassⅠ类器械产品,Class C、B类体外诊断设备
2027年5月26日,Class A类体外诊断设备
(*法规索引: MDR Article 123(3)(f),Article 27(4)&IVDR Article 113(3)(e), Article 24(4))
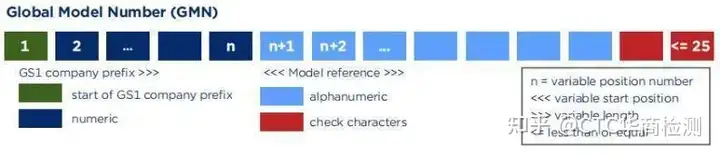
Basic-UDI结构
Basic-UDI主要由厂商识别码+型号代码+校验符组成,如下图所示:
申请流程
Basic-UDI申请流程和要求:
1.企业联系GS1(就是中国的“中国物品编码中心"”),付费,成为会员,得到"GS1 Company Prefix"。
2.企业给自己产品编一个"Internal number”。同类型的产品,生产工艺类似,预期用途相同,技术特性类似,可以分同一个代码。
3.把两组数字输入到以下网页,点击"Calculate",就会得到Basic UDI。
一般而言,企业申请到Basic-UDI与正确使用Basic-UDI之间还存在较大的差距,建议企业寻求专业的服务商来完成完成相关工作。

部分过审案例